
Stand der Entwicklung
Die Behandlung mit demethylierenden Substanzen stellt einen innovativen und ursächlichen Behandlungsansatz für HPV-verursachte Tumoren dar.1
Ein solcher Ansatz ist insbesondere vielversprechend für HPV-verursachte Krebsvorstufen im Anogenitalbereich. Alleine in Europa treten jedes Jahr bis zu 540.000 neue HPV-verursachte Krebsvorstufen im äußeren und inneren Genitalbereich sowie im Analkanal auf.2 Gegenwärtig stellen die chirurgische Entfernung mittels Exzision (Ausschneidung) und/oder Ablation (Zerstörung) des erkrankten Gewebes, z.B. mittels Laser, den Therapiestandard bei HPV-verursachten Krebsvorstufen dar. Da bei diesen operativen Verfahren in unterschiedlichem Ausmaß auch benachbartes gesundes Gewebe in Mitleidenschaft gezogen wird, können bei einem Teil der behandelten Patientinnen und Patienten Nebenwirkungen wie Blutungen, Infektionen, oder eine erhöhte Rate an Frühgeburten (bei Entfernung von Krebsvorstufen am Gebärmutterhals) auftreten. Je nach Lokalisation der Krebsvorstufe kommt es in bis zu einem Drittel der Fälle zu einem Wiederauftreten der Krebsvorstufe (Rezidiv) nach Behandlung. Diese Situation verdeutlicht den großen Bedarf für effektive, aber gleichzeitig auch schonende Lokaltherapien für HPV-verursachte Krebsvorstufen.3
Um unseren neuen Behandlungsansatz in die praktische Anwendung zu bringen, haben wir in umfangreichen Entwicklungsarbeiten erstmalig eine lokal wirksame (topische) Darreichungsform einer demethylierenden Substanz entwickeln können.
Dadurch wird es möglich, den Wirkstoff direkt auf erkrankte Stellen an Haut und Schleimhaut aufzubringen. Auf diese Weise soll eine Aufnahme des demethylierenden Wirkstoffs in Tumorzellen erreicht und das umliegende Normalgewebe so gut wie möglich geschont werden. Eine topische Darreichungsform erlaubt auch die Selbst-Anwendung durch Betroffene, so dass die Behandlung gut in den Alltag eingebaut werden kann.
Gegenwärtig bestimmen wir die Sicherheit und Verträglichkeit sowie vorläufige Daten zur Wirksamkeit des entwickelten Prüfpräparats in einer ersten klinischen Studie (DelVIN-Studie) bei Patientinnen mit HPV-verursachten Krebsvorstufen an der Vulva. Diese Krebsvorstufen werden auch als „vulväre intraepitheliale Neoplasien (VIN) Grad 2/3“ bezeichnet.
Des Weiteren wollen wir unseren neuen Behandlungsansatz durch die Entwicklung von weiteren Darreichungsformen auch für andere HPV-verursachte Krebsvorstufen im Anogenitalbereich sowie andere Tumoren, die auf eine demethylierende Therapie ansprechen können, nutzbar machen. Eine Übersicht über den aktuellen Stand unserer Entwicklungen finden Sie in der folgenden Abbildung.
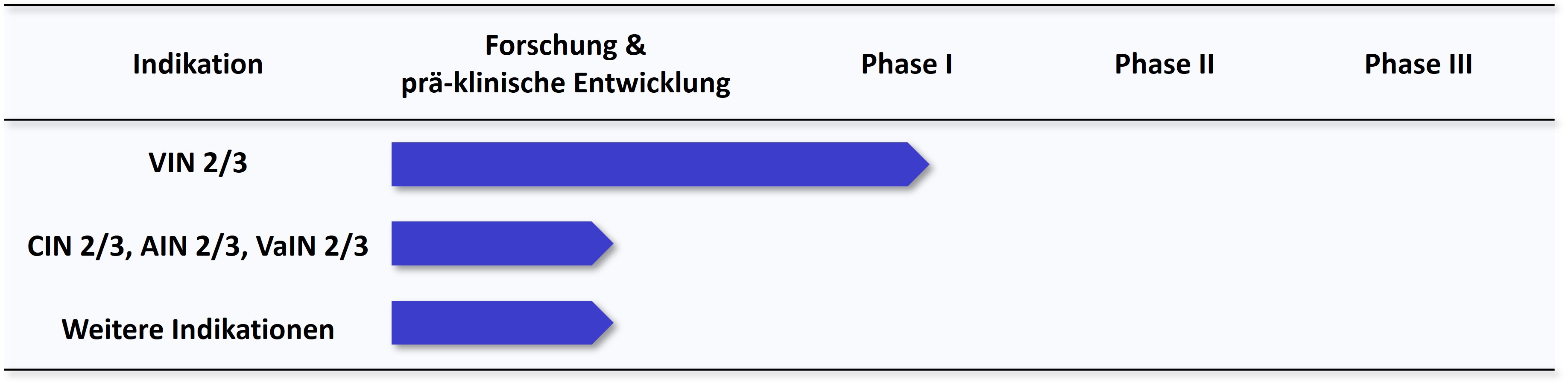
VIN, CIN, AIN, VaIN 2/3: Vulväre, Cervikale, Anale, Vaginale Intraepitheliale Neoplasien Grad 2/3
(Krebsvorstufen an Vulva, Cervix (Gebärmutterhals), Analkanal, Vagina)